Bir önceki yazıda redoks reaksiyonunun ne olduğunu tartıştık. Eczacılık, biyoloji, endüstri, metalurji ve tarım alanlarında yaygın olarak kullanılan redoks reaksiyonları, aynı anda meydana gelen oksidasyon ve indirgeme reaksiyonları türleridir. Bir redoks reaksiyonu sırasında, kaybedilen elektron sayısı, kazanılan elektron sayısına eşittir.
Redoks reaksiyonları, indirgeme ve oksidasyon reaksiyonlarından oluşur. İndirgeme, bir maddeden oksijeni veya elektronegatif bir elementi çıkarma veya bir maddeye hidrojen veya elektropozitif bir element ekleme işlemidir. Bu arada oksidasyon, bir maddeye oksijen veya herhangi bir elektronegatif elementin eklenmesi veya bir maddeden hidrojenin veya herhangi bir elektropozitif elementin çıkarılmasıdır.
Kombinasyon reaksiyonları, ayrışma, değişim ve orantısızlık gibi aşina olduğumuz birkaç redoks reaksiyonu türü vardır.
Kombinasyon Reaksiyonu
Kombine reaksiyonlar, iki veya daha fazla elementin tek bir bileşik oluşturmak için birleştiği reaksiyonlardır.
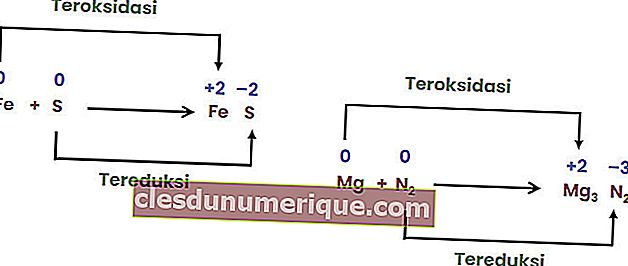
Ayrışma reaksiyonu
Ayrışma veya ayrışma reaksiyonu, bir bileşik parçalandığında veya iki veya daha fazla basit maddeye veya elemente ayrıldığında oluşan bir reaksiyondur. Ayrışma reaksiyonları genellikle birleşik reaksiyonların tersi olarak adlandırılır.
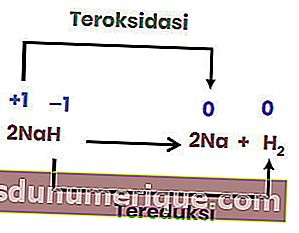
Bununla birlikte, tüm ayrışma reaksiyonları redoks reaksiyonları değildir. Bir örnek aşağıdaki reaksiyondur.
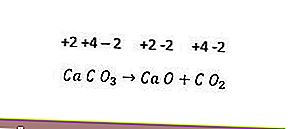
Her elementte yükseltgenme sayısında değişiklik olmadığı için yukarıdaki reaksiyon bir redoks reaksiyonu değildir. Bir ayrışma reaksiyonunun bir redoks reaksiyonu haline gelmesi için, oluşan bileşenlerden en az birinin elemental formda olması gerekir.
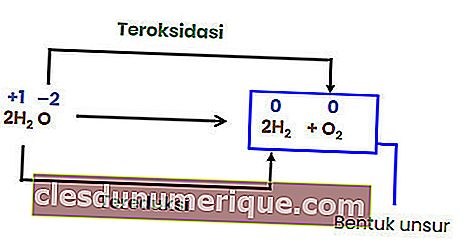
Değişim Tepkisi
Bir değişim veya değiştirme reaksiyonu, bir bileşikteki atomların veya iyonların başka bir bileşikten atomlar veya iyonlarla değiştirildiği bir reaksiyondur. Değiştirme reaksiyonları, metal ve metal olmayan değişimler olarak sınıflandırılır.
(Ayrıca şunu okuyun: Redox Reaksiyonları Hakkında Bilgi Edinin)
Metal değişimi, bir bileşikteki bir metal, serbest durumda daha reaktif olan bir metal ile değiştirildiğinde meydana gelir. Bir örnek aşağıdaki reaksiyondur.

Metal değiştirme reaksiyonları, cevherde bulunan bileşiklerden saf metal elde edildiğinde metalurjik işlemlerde faydalıdır.
Bu arada, metal olmayan ikame reaksiyonları arasında hidrojen, halojen ve bazen de oksijenin yer değiştirmesi yer alır. Tüm alkali metaller ve bazı toprak alkali metaller (Ca, Sr ve Ba) soğuk sudaki hidrojenin yerini alır. Aşağıdaki reaksiyonda bir örnek görülebilir.
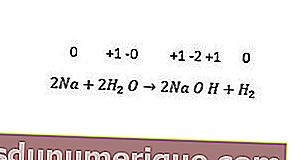
Orantısızlık reaksiyonu
Son redoks reaksiyonu tipi orantısızlıktır. Bu reaksiyon, aynı element aynı anda oksitlendiğinde ve indirgendiğinde meydana gelir. Üç veya daha fazla oksidasyon sayısına sahip elementler, kendi oksitleyici maddeleri ve indirgeme maddeleri olarak hareket edebilir. Bir örnek aşağıdaki reaksiyondur.
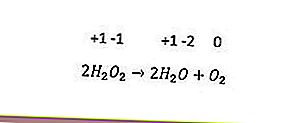
Yukarıdaki reaksiyonda, oksijenin oksidasyon sayısı (-1) -2'ye indirgenir ve 0'a oksitlenir.









