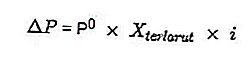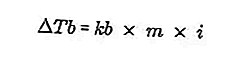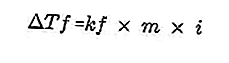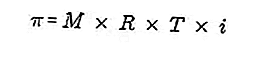Kimyayla ilgili çevremizdeki şeylere dikkat etmeye çalışın? En kolayı soluduğumuz, oksijen, nitrojen ve diğer gazların karışımını içeren havadır. Gıda baharatları, gıda boyası ve gıda koruyucuları da çevremizdeki diğer kimyasal örneklerdir. Kimya, okulda okuyacağınız ve çeşitli materyalleri inceleyen bir doğa bilimleri dalıdır, buna bir örnek maddenin yapısı, maddenin özellikleri, materyal formu, maddenin değişimleri, maddenin sınıflandırılması, maddenin bileşimi ve bu değişikliklere eşlik eden enerjidir. Sadece matematik ve fizik değil, kimyanın da çeşitli formülleri vardır, biliyorsunuz. Kolligatif özelliklerden redoks reaksiyonlarına kadar pek çok kimyasal formül var.
Bu vesileyle, çeşitli kimyasal formülleri ve ayrıca kimyasal formüllerin kavramlarını anlamanıza yardımcı olacak problem örneklerini öğreneceğiz.
Kimyasal Formüller ve Örnek Problemler
Kimyadaki formüllerin varlığı, araştırmacıların yürütülecek çeşitli deneysel sonuçları bulmalarına yardımcı olmaktır. Bu bilime hakim olabilmek için, kimya okurken sıklıkla karşılaşacağınız bazı kimyasal formülleri bilmeniz gerekir.
Çözümün Kolligatif Özellikleri Formülü
Bir çözeltinin kolligatif özellikleri, bir çözülebilir madde türüne bağlı olmayan, yalnızca çözeltideki parçacıkların konsantrasyonuna bağlı olan bir çözelti niteliğidir. Daha sonra, çözeltinin kolligatif doğası iki tür özellikten oluşur: elektrolit çözeltisinin kolligatif doğası ve elektrolit olmayan çözeltinin kolligatif doğası.
- Elektrolit Olmayan Çözeltilerin Kolligatif Özellikleri
Kolligatif yapı bir çözelti içermesine rağmen, birleştirici yapı, çözünen ve çözünen moleküllerin etkileşimine değil, bir çözelti içinde çözünen çözünen madde miktarına bağlıdır. Kolligatif özellikler, buhar basıncında bir düşüş, kaynama noktasında artış, donma noktasında azalma ve ozmotik basınçtan oluşur. Her biri, sonucu elde etmek için kimyasal bir formül gerektirir.
- Buhar basıncı düşüş denklemi

Kaynak: formula.co.id
- Kaynama noktası artış denklemi
Bir sıvının kaynama noktası, kaynadığı sabit sıcaklıktır. Bu sıcaklıkta sıvının buhar basıncı, etrafındaki hava basıncında bir denkleme sahiptir ve sıvının tüm kısımlarının buharlaşmasından kaynaklanır. Bir sıvının kaynama noktası 1 atmosferlik bir basınçla ölçülebilir.
Bir çözeltinin kaynama noktası ile saf bir çözücünün kaynama noktası arasındaki fark, kaynama noktasındaki artış olarak adlandırılır, kaynama noktasındaki artış denklemi:

Kaynak: formula.co.id
- Donma Noktası türev denklemi
Çözeltide bulunan bir çözünen, çözeltinin donma noktasını çözücünün donma noktasından daha küçük hale getirecektir. Donma noktası azaltma denklemi:

Kaynak: formula.co.id
- Ozmotik basınç
Ozmotik basınç, çözücünün basıncını yarı yarı iletken membrandan çözelti boyunca dengelemek için gereken bir kuvvettir.
Yarı geçirgen bir zar, çözücü moleküllerin geçebildiği, ancak çözünen maddelerin geçemediği bir zardır. Van't Hoff'a göre ozmotik basınçta çözelti aşağıdaki gibi formüle edilir:

Kaynak: formula.co.id
- Elektrolit çözeltilerinin kolligatif özellikleri
Konsantrasyonda, aynı elektrolit solüsyonunun kolligatif özellikleri, elektrolit olmayan solüsyonun kolligatif özellikleriyle karşılaştırdığımızda daha büyük bir değere sahiptir. Van't Hoff faktöründe formüle edilmiş elektrolit çözeltisinin iyonlaşma reaksiyonundan kaynaklanan çok sayıda çözünen partikül nedeniyle.
Elektrolit çözeltilerinin kolligatif özelliklerinin hesaplanması her zaman aşağıdaki gibi Van't Hoff faktörü ile çarpılacaktır:

Kaynak: formula.co.id
Diğer elektrolit çözeltilerinin Kolligatif özellikleri için bazı formüller şunlardır:
- Buhar basıncında düşüş
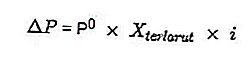
Kaynak: formula.co.id
- Kaynama noktası artışı
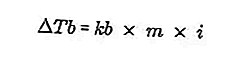
Kaynak: formula.co.id
- Donma noktası düşüşü
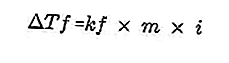
Kaynak: formula.co.id
- Ozmotik basınç
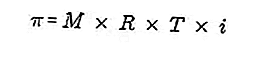
Kaynak: formula.co.id
Molarite, Molalite ve Mol Fraksiyon Formülleri
Molarite (M)
Molarite, 1 litre çözelti içinde çözünen bir maddenin mol sayısıdır.

Kaynak: formula.co.id
M = molarite
Mr = çözünen maddenin molar kütlesi (g / mol)
V = çözüm hacmi
Molalite (m)
Molalite, 1 kg çözücü içinde çözünen maddenin mol sayısıdır. Kimyasal formül aşağıdaki gibidir.

Kaynak: formula.co.id
m = molalite (mol / kg)
Mr = çözünen maddenin molar kütlesi (g / mol)
kütle = çözünen maddenin kütlesi (g)
P = çözücü kütlesi (g)
Mol fraksiyonu
Mol fraksiyonu, çözeltinin tüm bileşenlerinin mol bazında hesaplandığı bir konsantrasyon birimidir.

Kaynak: formula.co.id
xi = mol sayısı
i, j, xj = mol kesri
Kimyasal formül problemlerine örnekler
1. 32 ° C'den 500 ml fruktoz çözeltisi, C6H12O6'nın ozmotik basıncı 2 atm ise, çözünmüş fruktoz kütlesi miktarı?
Çözüm:

2. Üre çözeltisinin sudaki mol fraksiyonunda 0.2. 20 ° C sıcaklıktaki saf suyun doymuş buhar basıncı 17,5 mmHg'dir. Sonra çözelti doymuş buhar basıncı aşağıdaki sıcaklıkta?
X üre + X su = 1
0.2 + X su = 1
X su = 0.8
P çözelti = X su x P su
P çözeltisi = 0.8 x 17.5 mmHg
P çözeltisi = 14 mmHg
Bunlar, çeşitli kimya sorularını yanıtlamanızı kolaylaştırmak için öğrenebileceğiniz bazı kimyasal formüllerdir. Bu formüllerin yeterli olmadığını düşünüyorsanız, Trigonometri, Limit, Logaritma gibi Akıllı Sınıf için ağırlıklı, eksiksiz, çevrimiçi bir uygulama çözümü olan PROBLEM ürününü deneyebilirsiniz. Matematik, fizik, kimya ve diğerleri gibi çeşitli konularda ilkokul, ortaokul ve lise seviyelerinden başlayarak. Burada örnek problemlerle tamamlanmış çeşitli formüller öğrenebilirsiniz.
Hadi, ne bekliyorsun! Şimdi Smart Class'ta PROBLEM egzersizlerini deneyelim.